Être rappelé
Demandez un rendez-vous
"*" indicates required fields
Être rappelé
Qu’est ce qu’un neurinome de l’acoustique ?
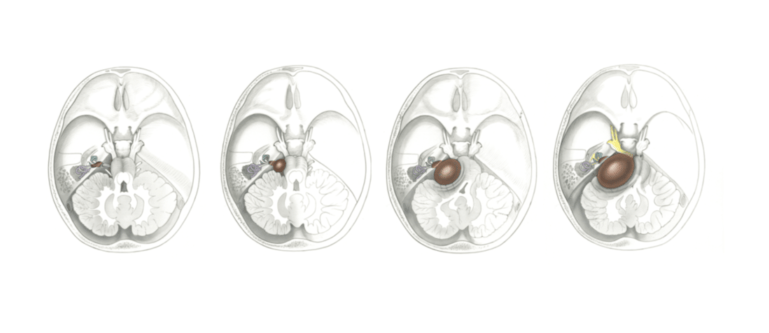
Le neurinome de l’acoustique concerne environ 10 personnes sur un million par an. Cette tumeur bénigne (non cancéreuse) se présente sous la forme d’une petite grosseur dans l’oreille interne et peut s’étendre à l’intérieur du cerveau.
C’est une tumeur dérivant des cellules de Schwann (qui élaborent normalement la gaine de protection des fibres contenues dans les nerfs), et survenant deux fois plus souvent sur la branche vestibulaire de la 8e paire crânienne (voir ci-après), que sur la branche du nerf auditif. Le neurinome de l’acoustique représente environ 7 % de toutes les tumeurs situées à l’intérieur du crâne. Sa cause est pour l’instant inconnue.
Cette variété de neurinome atteint les personnes entre 30 et 60 ans, (ou même plus jeunes) et plus particulièrement de sexe féminin. L’extension de la tumeur va se faire de l’intérieur du conduit auditif interne vers l’angle pond au cérébelleux (zone du système nerveux de l’encéphale située entre le cervelet en arrière, la moelle épinière en bas et le cerveau au-dessus). A cet endroit, il va comprimer progressivement le cervelet et le tronc cérébral puis les 5ème et 7ème paires crâniennes.
Quels sont les symptômes du neurinome de l’acoustique?
Voici les principales manifestations:
- Perte auditive unilatérale progressive
- Acouphènes (bourdonnements ou sifflements dans l’oreille)
- Vertiges, déséquilibre, sensation vertigineuse notamment dans la pénombre
- Ataxie ou difficultés de coordination
- Parfois, des symptômes plus graves tels que des maux de tête et des changements dans la perception faciale, troubles de la déglutition peuvent survenir si la tumeur est grande.
Acouphène unilatéral, signe le plus sensible, mais le moins spécifique (80 %), baisse de l’acuité auditive, surdité unilatérale ou bilatérale avec forte prédominance d’un côté; c’est le signe le plus spécifique (75 %), ataxie ( troubles de l’équilibre) une instabilité, même transitoire (16 %), vertiges répétés et larvés (2 %), une hémi-anesthésie par atteinte du V (20 %), des céphalées (30 %).
Une surdité unilatérale ou asymétrique doit éveiller les soupçons et nécessite des investigations complémentaires.
Comment faire le diagnostic du neurinome?
Le diagnostic du neurinome de l’acoustique s’appuie principalement sur l’évaluation de l’audition et des fonctions vestibulaires, ainsi que sur l’imagerie par résonance magnétique (IRM) du cerveau et de l’oreille interne.
-
L’audiogramme:
Il révèle généralement une perte auditive neurosensorielle unilatérale, ou une aggravation unilatérale chez les patients souffrant déjà d’une perte auditive bilatérale. Pour compléter l’évaluation diagnostique ou préparer le traitement, d’autres tests cochléo-vestibulaires peuvent être utilisés, tels que les potentiels évoqués auditifs, qui mesurent l’activité électrique du nerf auditif, et la vidéonystagmographie, qui est utilisée pour examiner les troubles de l’équilibre.
-
L’IRM:
Elle est considérée comme l’examen le plus fiable et le plus précis pour diagnostiquer un neurinome. Elle permet également de déterminer avec exactitude la taille, la localisation, l’étendue de la tumeur et son impact sur les structures avoisinantes. L’IRM avec injection de gadolinium donnera un résultat plus précis.
-
Le scanner:
Bien que le scanner soit moins fiable et sensible que l’IRM pour le diagnostic des neurinomes, il peut fournir des informations précieuses aux chirurgiens (ORL et neurochirurgiens) pour élaborer une stratégie thérapeutique.
-
PEA (Potentiels Evoqués Auditifs) :
Les potentiels évoqués du tronc cérébral constituent une épreuve utilisée pour mettre en évidence une lésion d’origine neurologique. Ils permettent l’étude de l’activité électrique des nerfs appartenant au système de l’audition, de la vision et de la sensibilité en général. Le résultat est une réponse électrique à des stimulations des différentes natures (auditives, visuelles, sensitives).
-
Les épreuves caloriques:
Chez les patients présentant un neurinome de l’acoustique, l’épreuve calorique peut révéler une hyporéactivité ou une non-réactivité du côté affecté par la tumeur. Cela est dû à l’effet de compression ou de déplacement du nerf vestibulaire par la tumeur, ce qui peut réduire ou inhiber la transmission des signaux vestibulaires. L’asymétrie dans les réponses caloriques entre les deux oreilles est un indicateur significatif qui peut orienter le clinicien vers un diagnostic de neurinome de l’acoustique.
Comment peut évoluer un neurinome de l’acoustique?
L’augmentation de volume (très lente) du neurinome dans la cavité de l’oreille interne peut provoquer les signes suivants : Fourmillements au visage, douleurs au niveau du visage, dues à une atteinte de la région du nerf trijumeau au niveau de la face, paralysie de la zone du visage correspondant à l’innervation par le nerf facial, entraînant une atteinte des muscles faciaux, anesthésie de la cornée du côté du neurinome.
Quels sont les traitements?
Quatre sortes de traitements sont possibles selon la grosseur et la localisation du neurinome.
-
Le Gamma Knife
La radiochirurgie aux rayons gamma pour les neurinomes inférieurs a 3cm (gamma knife):
La radiochirurgie préserve l’audition et ne crée pas de paralysie faciale. Dans 95% des cas, après radiochirurgie, la tumeur n’évolue plus et on assiste à une nécrose progressive de la lésion parfois, il est vrai, sans modification volumétrique significative. Cela n’est pas dangereux. Le recul actuel de cette technique est de plus de 30 ans. Dans ± 5% des cas seulement, une intervention doit être envisagée secondairement. Les rayons gamma knife sont faits en une seule séance, 201 rayons sont ciblés sur le neurinome. Ils agissent pendant trois ans environ. Ce n’est qu’au bout de ces 3 années que l’on verra le résultat définitif du traitement. On peut éventuellement faire une autre séance de rayons si nécessaire. La chirurgie est possible après un traitement GK (Gamma Knife)
-
La chirurgie :
Le traitement chirurgical consiste en une ablation de la tumeur qui, comme lors de neurinome des nerfs rachidiens, nécessite un diagnostic précoce. L’opération risque toutefois d’abîmer le nerf crânien numéro VIII et, de ce fait, peut provoquer une paralysie faciale. Les tumeurs de petits volumes peuvent êtres enlevées par microchirurgie. Ceci permet généralement d’épargner le nerf facial si le chirurgien utilise la voie qui emprunte la fosse cérébrale moyenne de façon à préserver l’audition résiduelle. Une autre voie est la voie trans-labyrinthique (à travers le labyrinthe) à condition que la fonction auditive soit totalement supprimée. Les tumeurs plus volumineuses sont enlevées à travers le labyrinthe et par la voie sous-occipitale. La chirurgie du neurinome du VIII est une chirurgie compliquée et elle comporte des risques importants.
-
L’opération et la radiochirurgie :
Lorsque la tumeur est très grosse, il arrive que l’on opère en enlevant le plus gros de la tumeur et que l’on fasse pour ce qui reste les rayons gamma. Cela évite de trop abîmer les nerfs facial et auditif, et de limiter les séquelles.
-
La radiothérapie stéréotaxique :
La radiothérapie stéréotaxique représente une méthode de traitement non invasive pour les neurinomes de l’acoustique, particulièrement utile chez les patients pour lesquels la chirurgie représente un risque élevé ou ceux qui préfèrent une alternative moins invasive. Cette technique utilise des faisceaux de radiations de haute précision pour cibler la tumeur, minimisant ainsi les dommages aux tissus sains environnants.
-
La surveillance:
Une autre solution, lorsque la tumeur est petite, c’est de la “surveiller” régulièrement par des IRM et, si elle ne “bouge” pas du tout, de ne faire aucun des traitements précédents. L’évolution du neurinome de l’acoustique est en principe lente et il arrive quelques fois que le neurinome ne grossisse pas pendant de nombreuses années. Dans l’un ou l’autre des traitements cités, un contrôle par IRM sera fait tous les 6 mois au début, puis tous les ans, puis tous les 5 ans, afin de bien surveiller l’évolution et détecter éventuellement une récidive.
Est il possible de porter un appareil auditif si je souffre d’un neurinome de l’acoustique?
La réponse est oui. Le choix de l’appareil va dépendre du niveau et de la qualité de l’audition résiduelle.
-
Si l’audiométrie vocale est conservée du côté du neurinome:
Si l’audiométrie vocale est conservée, cela signifie qu’il sera possible de tirer un bénéfice significatif de l’appareillage auditif. Il faudra probablement adapter les réglages de l’aide auditive en fonction des seuils de conforts, des seuils d’inconfort et de la présence d’un éventuel recrutement (intolérance aux sons forts). Le recrutement est un phénomène fréquent lorsque le nerf auditif est abîmé par le neurinome de l’acoustique.
-
Si l’audiométrie vocale est fortement dégradée du côté du neurinome:
Si l’audiométrie vocale est fortement dégradée, un appareillage conventionnel du côté du neurinome donnera probablement un résultat décevant avec une faible amélioration de la capacité de compréhension lorsque un interlocuteur se trouve du côté sourd. La solution optimale sera alors un sytème TRi-Cros, Active Cros ou Stéréo Cros. Le principe est de router l’information perçue du coté de la mauvaise oreille vers la bonne oreille tout en apportant une petite stimulation sonore sur la mauvaise.
-
Si il n’y a plus d’audition (cophose) du côté du neurinome:
Si il n’y a plus d’audition (cophose) du côté du neurinome, la solution qui soit être envisagée est un système Cros qui consiste à router le signal perçu du côté de l’oreille qui n’entend plus vers l’oreille qui entend. Il existe aujourd’hui deux types de systèmes Cros, les Cros avec appareil auditif à ancrage osseux (Cochlear Baha, Otico Ponto) et les Cros avec appareil auditif en conduction aérienne (Phonak Cros, Starkey Cros, Signia Cros). Le système Cros permet de rétablir une pseudo-stéréophonie.
En cas de troubles de l’audition, de l’équilibre, consultez votre médecin ORL. Il est le seul à pouvoir vous conseiller ou vous traiter.